Hi ha tres tipus d’elements químics i tres tipus bàsics d’enllaç, però una gran diversitat de materials i de propietats.
Hi ha 90 elements químics naturals, que, en un model molt simplificat, es poden classificar en tres tipus: Metalls, No metalls i gasos nobles.
El àtoms tenen un nucli amb càrrega positiva i una escorça amb diverses capes d’electrons amb càrrega negativa.
El nombre d’electrons de l’àtom a la darrera capa determina les propietats químiques d’un àtom.
La majoria de metalls tenen un, dos o tres electrons a la darrera capa i tenen tendència a perdre’ls.
La majoria de no metalls tenen quatre, cinc, sis o set electrons a la darrera capa i tenen tendència a completar la capa amb 8 electrons.
La majoria de gasos nobles tenen vuit electrons a la darrera capa, són estables i no fan cap enllaç. No formen compostos, ni molècules. Per aquest motiu són gasos.
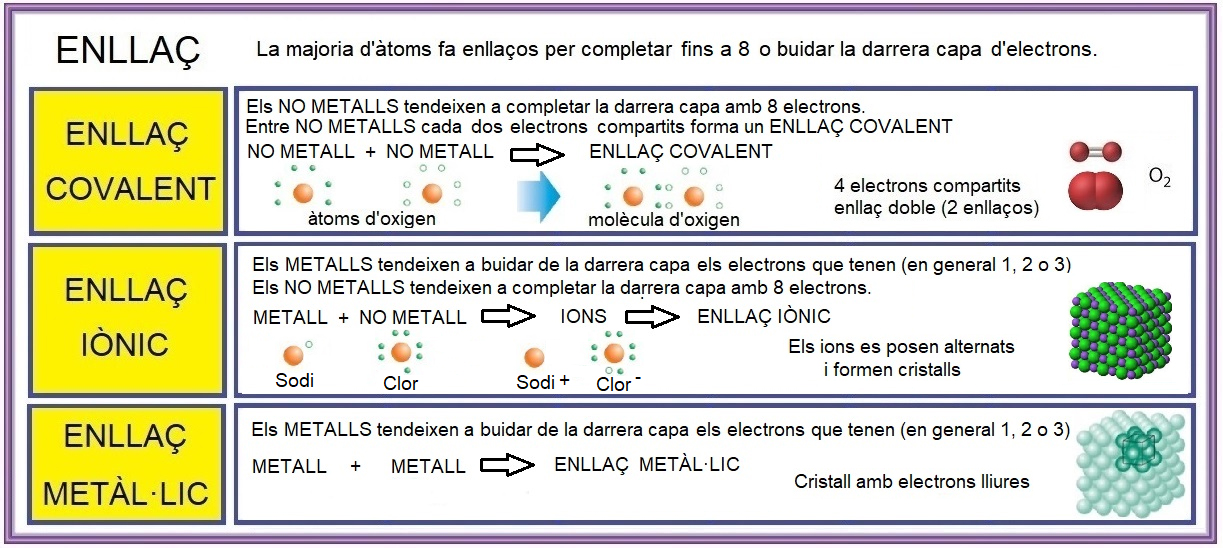
Metalls i no metalls sempre formen enllaços per aconseguir major estabilitat i, segons les condicions, poden fer bàsicament tres tipus d’enllaç: COVALENT, IÒNIC O METÀL·LIC.
ENLLAÇ COVALENT

Una forma de completar la darrera capa amb 8 electrons es compartir electrons. Un àtom de no metall, com l’oxigen que té 6 electrons, pot formar 2 enllaços covalents (pot agafar 2 electrons d’un altre o d’altres àtoms de no metall)
En aquest cas e formen molècules de 2, 3 o més àtoms.
Si les molècules formades són petites i no tenen polaritat les substàncies seran gasos. Encara que la molècula té enllaços forts, les molècules no estan unides i es mouen lliurement. Són exemples: l’oxigen, el nitrogen o el metà.
Quan les molècules són majors o tenen polaritat poden ser líquids, com l’aigua o l’esperit, o sòlids blans, bons de fondre com la cera d’espelma o la xocolata.
ENLLAÇ IÒNIC
Quan es combina un metall i un no metall els electrons no es comparteixen sinó que es cedeixen formant ions positius (cations) i negatius (anions) que per l’atracció electrostàtica s‘han de col·locar alternats formant cristalls sòlids, no deformables, mals de fondre.
Són les sals.
ENLLAÇ METÀL·LIC.

Quan només s’ajunten àtoms de metalls amb pocs electrons a la darrera capa es forma l’enllaç metàl·lic per unió dels àtoms de metall en un cristall sòlid on els electrons es poden moure lliurement. En aquest cas el sòlid es pot deformar amb més o menys dificultat. Els metalls, purs o mesclats, són conductors d’electricitat, dúctils i mal·leables.
Al gràfic es comparen les propietats de les substàncies segons el tipus d’enllaç que tenen. De tota manera, dins cada tipus, podem trobar molta diversitat de propietats, de forma que no hi dos metalls iguals, ni dues sals iguals. La naturalesa no és tan simple com aquest model que avui hem presentat.
ACTUALITAT
– Falta menys mes per a l’arribada de la nau Perseverance i altres al planeta Mart. L’arribada del Perseverance es preveu pel 18 de febrer. Esperem que l’aterratge a Mart ( amartatge? ) surti bé.




